Lịch sử phát triển của bảng nguyên tố hóa học
1. Những nỗ lực đầu tiên
Từ thời cổ đại, con người đã biết đến một số nguyên tố hóa học như vàng, bạc, đồng, sắt,… Tuy nhiên, việc phân loại và sắp xếp các nguyên tố hóa học một cách khoa học chỉ xuất hiện vào thế kỷ XIX. Năm 1862, nhà hóa học người Pháp Alexandre-Émile Béguyer de Chancourtois đã tạo ra một bảng tuần hoàn sơ khai dựa trên khối lượng nguyên tử của các nguyên tố. Ông sắp xếp các nguyên tố theo thứ tự tăng dần khối lượng nguyên tử và nhận thấy rằng tính chất của chúng có xu hướng lặp lại theo chu kỳ.
2. Bảng tuần hoàn của Mendeleev
Năm 1869, nhà hóa học người Nga Dimitri Mendeleev đã công bố một bảng tuần hoàn các nguyên tố dựa trên tính chất hóa học của chúng. Bảng tuần hoàn của Mendeleev bao gồm 63 nguyên tố hóa học, được sắp xếp theo thứ tự tăng dần khối lượng nguyên tử. Ông đã dự đoán chính xác tính chất của một số nguyên tố chưa được khám phá vào thời điểm đó, và bảng tuần hoàn của ông đã trở thành nền tảng cho bảng tuần hoàn hiện đại.
3. Bảng tuần hoàn hiện đại
Bảng tuần hoàn hiện đại được phát triển dựa trên bảng tuần hoàn của Mendeleev. Năm 1913, nhà vật lý người Anh Henry Moseley đã xác định được số lượng proton trong hạt nhân của mỗi nguyên tố, gọi là số hiệu nguyên tử. Ông đã chứng minh rằng số hiệu nguyên tử là một đại lượng cơ bản hơn khối lượng nguyên tử và nên được sử dụng để sắp xếp các nguyên tố trong bảng tuần hoàn.
Bảng tuần hoàn hiện đại bao gồm 118 nguyên tố hóa học, được sắp xếp theo thứ tự tăng dần số hiệu nguyên tử. Các nguyên tố có cùng số lớp electron ngoài cùng được xếp cùng một cột, gọi là nhóm. Các nguyên tố có cùng số lớp electron được xếp cùng một hàng, gọi là chu kỳ.
Cấu trúc và thành phần của bảng nguyên tố hóa học
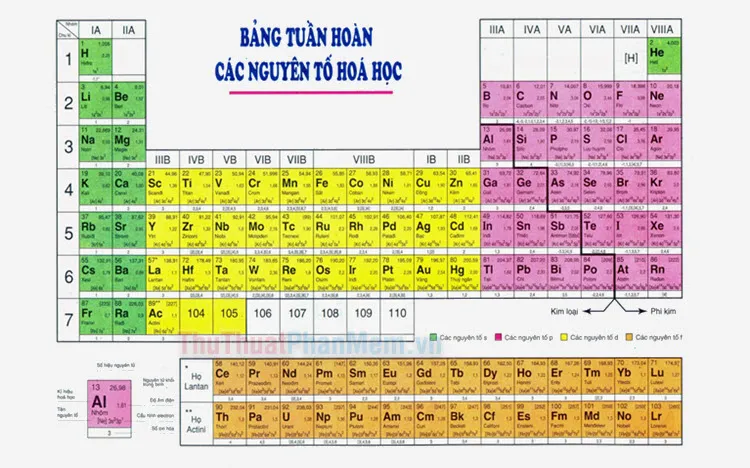
1. Cấu trúc chính
Bảng tuần hoàn các nguyên tố hóa học hiện đại được cấu trúc theo các nhóm và chu kỳ.
- Nhóm: Các nguyên tố trong cùng một nhóm có cùng số electron hóa trị, tức là số electron trong lớp electron ngoài cùng. Nhóm cũng biểu thị số electron hóa trị của các nguyên tố thuộc nhóm đó. Các nhóm được đánh số từ I đến VIII, và được chia thành hai nhóm chính: nhóm A và nhóm B.
- Nhóm A (nhóm chính): Bao gồm các nguyên tố có electron hóa trị nằm trong lớp electron ngoài cùng.
- Nhóm B (nhóm phụ): Bao gồm các nguyên tố có electron hóa trị nằm trong lớp electron sát lớp electron ngoài cùng.
- Chu kỳ: Các nguyên tố trong cùng một chu kỳ có cùng số lớp electron. Các chu kỳ được đánh số từ 1 đến 7, tương ứng với số lớp electron của các nguyên tố trong chu kỳ đó.
2. Thành phần
Bảng tuần hoàn gồm 118 nguyên tố hóa học, mỗi nguyên tố đại diện cho một loại nguyên tử riêng biệt. Mỗi nguyên tố được biểu diễn bằng ký hiệu hóa học, nguyên tử khối, số hiệu nguyên tử và hóa trị.
- Ký hiệu hóa học: Là ký hiệu viết tắt cho nguyên tố, thường dựa trên tên tiếng Latin của nguyên tố. Ví dụ: Ký hiệu hóa học của hydro là H, của oxygen là O, của carbon là C.
- Số hiệu nguyên tử (Z): Là số lượng proton có trong hạt nhân nguyên tử. Số hiệu nguyên tử xác định vị trí của nguyên tố trong bảng tuần hoàn.
- Nguyên tử khối (A): Là tổng số proton và neutron có trong hạt nhân nguyên tử. Nguyên tử khối được tính gần đúng bằng tổng số proton và neutron.
- Hóa trị: Là khả năng liên kết của nguyên tố đó với các nguyên tố khác. Hóa trị được biểu diễn bằng số La Mã và thường được ghi ở góc trên bên phải ký hiệu hóa học của nguyên tố.
Tính chất và ý nghĩa của bảng nguyên tố hóa học
1. Tính chất tuần hoàn của các nguyên tố
Bảng tuần hoàn thể hiện tính chất tuần hoàn của các nguyên tố hóa học. Tính chất tuần hoàn là sự lặp lại theo chu kỳ của các tính chất hóa học và vật lý của các nguyên tố khi xét theo thứ tự tăng dần số hiệu nguyên tử.
- Tính chất hóa học tuần hoàn: Ví dụ, tính kim loại giảm dần khi đi từ trái sang phải trong một chu kỳ, tính phi kim tăng dần khi đi từ trái sang phải trong một chu kỳ, tính kim loại tăng dần khi đi từ trên xuống dưới trong một nhóm, tính phi kim giảm dần khi đi từ trên xuống dưới trong một nhóm.
- Tính chất vật lý tuần hoàn: Ví dụ, nhiệt độ nóng chảy và nhiệt độ sôi của các nguyên tố thay đổi theo chu kỳ, khối lượng riêng, độ dẫn điện, độ dẫn nhiệt của các nguyên tố cũng có xu hướng lặp lại theo chu kỳ.
2. Ý nghĩa của bảng tuần hoàn
Bảng tuần hoàn có ý nghĩa to lớn trong việc nghiên cứu và ứng dụng hóa học:
- Dự đoán và giải thích tính chất của các nguyên tố: Bảng tuần hoàn giúp chúng ta dự đoán và giải thích tính chất hóa học và vật lý của các nguyên tố. Việc hiểu rõ tính chất của các nguyên tố giúp chúng ta ứng dụng hiệu quả trong thực tiễn.
- Hỗ trợ việc học hóa học: Bảng tuần hoàn cung cấp một cái nhìn tổng quan và hệ thống về các nguyên tố hóa học, giúp các học sinh dễ dàng hơn trong việc học hỏi và ghi nhớ kiến thức hóa học.
- Công cụ nghiên cứu khoa học: Bảng tuần hoàn là công cụ quan trọng trong nghiên cứu khoa học, nó giúp các nhà khoa học hiểu rõ hơn về cấu trúc, tính chất và mối quan hệ giữa các nguyên tố hóa học.
- Ứng dụng trong công nghiệp: Bảng tuần hoàn đóng vai trò quan trọng trong ngành công nghiệp, từ việc sản xuất thuốc, phân bón, vật liệu xây dựng đến việc khai thác và chế biến khoáng sản.
Cách sắp xếp các nguyên tố trong bảng nguyên tố hóa học
1. Sắp xếp theo số hiệu nguyên tử
Bảng tuần hoàn được sắp xếp theo thứ tự tăng dần số hiệu nguyên tử (số lượng proton). Số hiệu nguyên tử của một nguyên tố được xác định bằng số lượng proton trong hạt nhân của nguyên tử đó.
2. Sắp xếp theo nhóm và chu kỳ
Bảng tuần hoàn được chia thành các nhóm và chu kỳ.
- Nhóm: Các nguyên tố trong cùng một nhóm có cùng số electron hóa trị và có tính chất hóa học tương tự nhau.
- Chu kỳ: Các nguyên tố trong cùng một chu kỳ có cùng số lớp electron và có xu hướng thay đổi tính chất hóa học và vật lý theo chu kỳ.
3. Sắp xếp theo khối
Bảng tuần hoàn được chia thành 4 khối: khối s, p, d, và f.
- Khối s: Bao gồm các nguyên tố có electron hóa trị nằm trong phân lớp s, thường là các nguyên tố có tính kim loại.
- Khối p: Bao gồm các nguyên tố có electron hóa trị nằm trong phân lớp p, bao gồm cả kim loại, phi kim và khí hiếm.
- Khối d: Bao gồm các nguyên tố có electron hóa trị nằm trong phân lớp d, thường là các kim loại chuyển tiếp.
- Khối f: Bao gồm các nguyên tố có electron hóa trị nằm trong phân lớp f, thường là các nguyên tố đất hiếm.
Các nhóm nguyên tố trong bảng nguyên tố hóa học
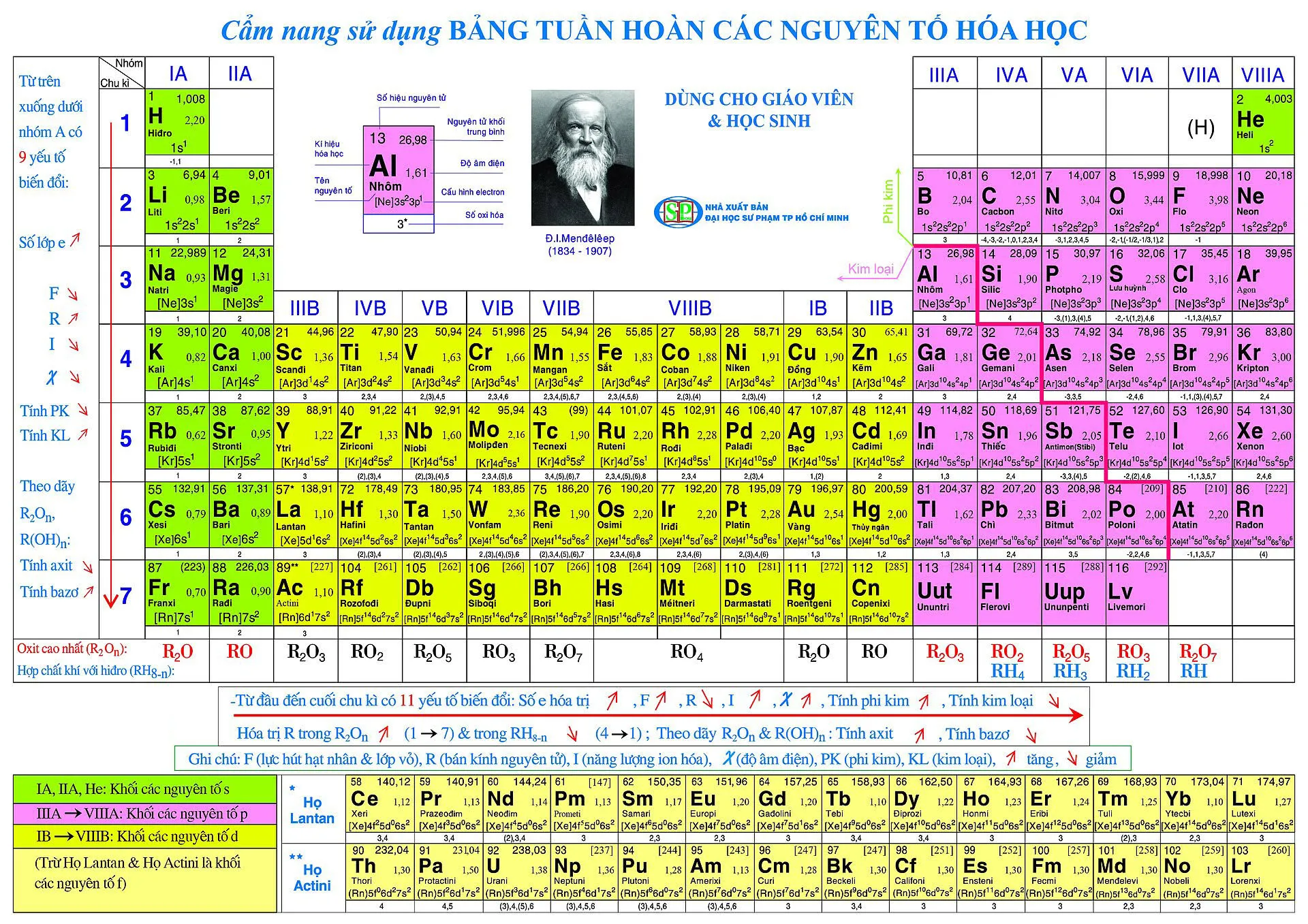
1. Nhóm kim loại kiềm (nhóm IA)
Nhóm kim loại kiềm bao gồm các nguyên tố Li, Na, K, Rb, Cs và Fr. Các nguyên tố thuộc nhóm IA đều có 1 electron hóa trị, có tính kim loại mạnh, dễ phản ứng với nước và oxi để tạo thành bazơ.
- Tính chất:
- Có tính kim loại mạnh nhất trong bảng tuần hoàn.
- Nhẹ, mềm, dễ nóng chảy và bay hơi.
- Phản ứng mạnh với nước để tạo thành dung dịch bazơ và giải phóng khí hydro.
- Phản ứng mạnh với oxygen để tạo thành oxit.
- Ứng dụng:
- Natri (Na) được sử dụng trong sản xuất muối, xà phòng, và là chất dẫn điện trong pin.
- Kali (K) là thành phần chủ yếu của phân bón và được sử dụng trong sản xuất thuốc nổ.
- Liti (Li) được sử dụng trong sản xuất pin lithium-ion, thuốc chữa bệnh tâm thần và là chất làm mát trong lò phản ứng hạt nhân.
2. Nhóm kim loại kiềm thổ (nhóm IIA)
Nhóm kim loại kiềm thổ bao gồm các nguyên tố Be, Mg, Ca, Sr, Ba và Ra. Các nguyên tố thuộc nhóm IIA đều có 2 electron hóa trị, có tính kim loại mạnh nhưng yếu hơn nhóm IA, dễ phản ứng với nước và oxi để tạo thành bazơ.
- Tính chất:
- Có tính kim loại mạnh, nhưng yếu hơn nhóm IA.
- Nhẹ hơn, ít phản ứng với nước hơn nhóm IA.
- Phản ứng với oxygen để tạo thành oxit.
- Ứng dụng:
- Canxi (Ca) là thành phần chính của xương, răng và được sử dụng trong sản xuất bê tông và vữa.
- Magie (Mg) được sử dụng trong sản xuất hợp kim nhẹ, thuốc nhuộm, và là chất chống cháy.
- Beryllium (Be) được sử dụng trong sản xuất vật liệu chịu nhiệt và là chất điều khiển phản ứng hạt nhân.
3. Nhóm halogen (nhóm VIIA)
Nhóm halogen bao gồm các nguyên tố F, Cl, Br, I và At. Các nguyên tố thuộc nhóm VIIA đều có 7 electron hóa trị, có tính phi kim mạnh, dễ phản ứng với kim loại để tạo thành muối.
- Tính chất:
- Có tính phi kim mạnh nhất trong bảng tuần hoàn.
- Dễ phản ứng với kim loại để tạo thành muối.
- Tính phi kim giảm dần từ trên xuống dưới trong nhóm.
- Ứng dụng:
- Flo (F) được sử dụng trong sản xuất nhựa Teflon, thuốc trừ sâu, và là chất khử trùng trong nước uống.
- Clo (Cl) được sử dụng trong sản xuất nước Javen, thuốc tẩy, và là chất khử trùng trong bể bơi.
- Brom (Br) được sử dụng trong sản xuất thuốc trừ sâu, thuốc nhuộm, và là chất khử trùng trong nước uống.
- Iot (I) được sử dụng trong sản xuất muối iot, thuốc sát trùng, và là thành phần của hormone tuyến giáp.
4. Nhóm khí hiếm (nhóm VIIIA)
Nhóm khí hiếm bao gồm các nguyên tố He, Ne, Ar, Kr, Xe và Rn. Các nguyên tố thuộc nhóm VIIIA đều có 8 electron hóa trị (ngoại trừ Helium có 2 electron hóa trị), có tính trơ hóa học, khó phản ứng với các nguyên tố khác.
- Tính chất:
- Có tính trơ hóa học rất cao.
- Là khí không màu, không mùi, không vị.
- Được tìm thấy trong khí quyển ở dạng nguyên tử đơn lẻ.
- Ứng dụng:
- Helium được sử dụng trong khí cầu, thiết bị y tế, và là chất làm mát trong thiết bị khoa học.
- Neon (Ne) được sử dụng trong đèn neon, laser, và là chất làm mát trong thiết bị khoa học.
- Argon (Ar) được sử dụng trong đèn sợi đốt, là chất bảo vệ trong hàn kim loại, và là chất làm mát trong thiết bị khoa học.
Các chu kỳ nguyên tố trong bảng nguyên tố hóa học
1. Chu kỳ 1
Chu kỳ 1 là chu kỳ ngắn nhất trong bảng tuần hoàn, chỉ bao gồm 2 nguyên tố: Hydro (H) và Helium . Các nguyên tố trong chu kỳ 1 đều có 1 lớp electron.
- Tính chất:
- Hydrogen (H) là nguyên tố nhẹ nhất, có tính khử mạnh.
- Helium là khí trơ, không màu, không mùi, không vị.
- Ứng dụng:
- Hydrogen được sử dụng làm nhiên liệu, sản xuất amonia, và là nguyên liệu cho tổng hợp hữu cơ.
- Helium được sử dụng trong khí cầu, thiết bị y tế, và là chất làm mát trong thiết bị khoa học.
2. Chu kỳ 2
Chu kỳ 2 bao gồm 8 nguyên tố: Lithium (Li), Beryllium (Be), Boron (B), Carbon (C), Nitrogen (N), Oxygen (O), Fluorine (F) và Neon (Ne). Các nguyên tố trong chu kỳ 2 đều có 2 lớp electron.
- Tính chất:
- Lithium (Li) là kim loại kiềm, có tính khử mạnh.
- Beryllium (Be) là kim loại kiềm thổ, có tính khử mạnh.
- Boron (B) là phi kim, có tính phi kim yếu.
- Carbon (C) là phi kim, có tính phi kim mạnh.
- Nitrogen (N) là phi kim, có tính phi kim mạnh.
- Oxygen (O) là phi kim, có tính phi kim mạnh.
- Fluorine (F) là phi kim, có tính phi kim mạnh nhất.
- Neon (Ne) là khí hiếm, có tính trơ hóa học.
- Ứng dụng:
- Carbon được sử dụng trong sản xuất than đá, kim cương, và là thành phần chính của các hợp chất hữu cơ.
- Nitrogen được sử dụng trong sản xuất phân bón, thuốc nổ, và là thành phần của khí quyển.
- Oxygen được sử dụng trong hô hấp, sản xuất thép, và là nguyên liệu cho phản ứng cháy.
3. Chu kỳ 3
Chu kỳ 3 bao gồm 8 nguyên tố: Sodium (Na), Magnesium (Mg), Aluminum (Al), Silicon (Si), Phosphorus (P), Sulfur (S), Chlorine (Cl) và Argon (Ar). Các nguyên tố trong chu kỳ 3 đều có 3 lớp electron.
- Tính chất:
- Sodium (Na) là kim loại kiềm, có tính khử mạnh.
- Magnesium (Mg) là kim loại kiềm thổ, có tính khử mạnh.
- Aluminum (Al) là kim loại, có tính khử mạnh.
- Silicon (Si) là phi kim, có tính phi kim yếu.
- Phosphorus (P) là phi kim, có tính phi kim mạnh.
- Sulfur (S) là phi kim, có tính phi kim mạnh.
- Chlorine (Cl) là phi kim, có tính phi kim mạnh.
- Argon (Ar) là khí hiếm, có tính trơ hóa học.
- Ứng dụng:
- Aluminum được sử dụng trong sản xuất máy bay, ô tô, và là vật liệu xây dựng.
- Silicon được sử dụng trong sản xuất chip vi xử lý, pin mặt trời, và là thành phần chính của cát.
- Phosphorus được sử dụng trong sản xuất phân bón, thuốc trừ sâu, và là thành phần của ADN.
1. Trong ngành công nghiệp
- Sản xuất vật liệu: Bảng tuần hoàn giúp chúng ta lựa chọn nguyên liệu phù hợp để sản xuất các loại vật liệu khác nhau, như kim loại, hợp kim, gốm sứ, nhựa, v.v.
- Sản xuất năng lượng: Bảng tuần hoàn giúp chúng ta lựa chọn nguyên liệu phù hợp để sản xuất năng lượng, như nhiên liệu hóa thạch, năng lượng hạt nhân, năng lượng mặt trời.
- Sản xuất hóa chất: Bảng tuần hoàn là công cụ không thể thiếu trong sản xuất hóa chất, giúp chúng ta lựa chọn nguyên liệu phù hợp, dự đoán tính chất sản phẩm và tối ưu hóa quy trình sản xuất.
- Ngành nông nghiệp: Bảng tuần hoàn giúp chúng ta lựa chọn phân bón phù hợp, giúp cây trồng phát triển tốt, tăng năng suất.
2. Trong y học
- Phát triển thuốc: Bảng tuần hoàn giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của các nguyên tố, từ đó phát triển các loại thuốc mới, hiệu quả hơn và an toàn hơn.
- Chẩn đoán bệnh: Bảng tuần hoàn giúp chúng ta sử dụng các nguyên tố như đồng vị phóng xạ để chẩn đoán bệnh, như chụp X quang, PET-CT.
- Điều trị bệnh: Bảng tuần hoàn giúp chúng ta sử dụng các nguyên tố để điều trị bệnh, như sử dụng cobalt để điều trị ung thư.
3. Trong lĩnh vực môi trường
- Xử lý ô nhiễm: Bảng tuần hoàn giúp chúng ta hiểu rõ hơn về tính chất của các nguyên tố gây ô nhiễm, từ đó đưa ra các phương pháp xử lý ô nhiễm hiệu quả.
- Bảo vệ môi trường: Bảng tuần hoàn giúp chúng ta lựa chọn các nguyên liệu thân thiện với môi trường, giảm thiểu tác động tiêu cực đến môi trường.
Các thông tin cơ bản về bảng nguyên tố hóa học
1. Số hiệu nguyên tử
Số hiệu nguyên tử (Z) là số lượng proton có trong hạt nhân nguyên tử. Số hiệu nguyên tử xác định vị trí của nguyên tố trong bảng tuần hoàn.
- Ví dụ: Nguyên tố Oxygen (O) có số hiệu nguyên tử là 8, có nghĩa là hạt nhân của nguyên tử Oxygen có 8 proton.
- Cách xác định số hiệu nguyên tử: Số hiệu nguyên tử được ghi ở góc trên bên trái ký hiệu hóa học của nguyên tố.
2. Nguyên tử khối
Nguyên tử khối (A) là tổng số proton và neutron có trong hạt nhân nguyên tử. Nguyên tử khối được tính gần đúng bằng tổng số proton và neutron.
- Ví dụ: Nguyên tố Oxygen (O) có nguyên tử khối là 16, có nghĩa là hạt nhân của nguyên tử Oxygen có 8 proton và 8 neutron.
- Cách xác định nguyên tử khối: Nguyên tử khối được ghi ở góc dưới bên trái ký hiệu hóa học của nguyên tố.
3. Hóa trị
Hóa trị là khả năng liên kết của nguyên tố đó với các nguyên tố khác. Hóa trị được biểu diễn bằng số La Mã và thường được ghi ở góc trên bên phải ký hiệu hóa học của nguyên tố.
- Ví dụ: Nguyên tố Oxygen (O) có hóa trị II, có nghĩa là Oxygen có thể tạo ra 2 liên kết hóa học với các nguyên tố khác.
Những điều cần biết khi nghiên cứu về bảng nguyên tố hóa học
1. Hiểu rõ các khái niệm cơ bản
Để nghiên cứu về bảng nguyên tố hóa học, bạn cần hiểu rõ các khái niệm cơ bản như số hiệu nguyên tử, nguyên tử khối, hóa trị, nhóm, chu kỳ, khối, tính kim loại, tính phi kim.
2. Nắm vững các quy luật tuần hoàn
Bảng tuần hoàn thể hiện tính chất tuần hoàn của các nguyên tố, hãy nắm vững các quy luật tuần hoàn để dự đoán và giải thích tính chất của các nguyên tố.
3. Luyện tập thường xuyên
Để ghi nhớ và áp dụng kiến thức về bảng nguyên tố hóa học, bạn cần luyện tập thường xuyên bằng cách giải các bài tập, làm các câu hỏi trắc nghiệm.
4. Sử dụng các tài liệu tham khảo
Hãy tham khảo các sách giáo khoa, bài giảng, website uy tín để tìm hiểu thêm về bảng nguyên tố hóa học.
Kết luận
Qua bài viết tìm hiểu về bảng nguyên tố hóa học từ Trung Tâm Ngoại Ngữ Đại Học Thủ Dầu Một cho thấy được sự ra đời của bảng nguyên tố hóa học là một công cụ hữu ích, giúp chúng ta hiểu rõ hơn về thế giới vật chất xung quanh. Việc nghiên cứu và ứng dụng bảng tuần hoàn đã góp phần quan trọng vào sự phát triển của khoa học và công nghệ. Bảng tuần hoàn là một cẩm nang toàn diện cho hóa học, giúp chúng ta giải quyết các vấn đề liên quan đến hóa học, từ việc học tập, nghiên cứu đến ứng dụng trong thực tế.

